Was ist die Gute Laborpraxis?
Begriffsbestimmung
Unter dem Begriff Gute Laborpraxis (GLP) oder Good Laboratory Practice kann ein formaler Rahmen für die Durchführung von Sicherheitsprüfungen verstanden werden. Gerade bei Chemikalien, pharmazeutischen und biotechnologischen Arzneimitteln, neuen Medikamenten oder auch Lebensmittelzusatzstoffen ist die Gute Laborpraxis (GLP) gesetzlich vorgeschrieben und wird regelmäßig durch behördlich angeordnete Inspektionen überprüft.1
Was besagen die Richtlinien der GLP?
Die Vorschriften der Guten Laborpraxis beziehen sich hauptsächlich auf spezifische Prüfungen von Stoffen und Zubereitungen, welche unter Einhaltung der GLP-Grundsätze durchzuführen sind. Die Ergebnisse dieser nichtklinischen und experimentellen Prüfungen ermöglichen eine Bewertung ihrer potenziellen Gefahren für Mensch und Umwelt.2
Innerhalb der regulatorischen Anforderungen der Guten Laborpraxis werden die organisatorischen Abläufe, sowie die Bedingungen, unter denen Laborprüfungen durchgeführt und überprüft werden, festgehalten. Darüber hinaus geben die Richtlinien der GLP vor, in welcher Form die Dokumentation und Berichterstattung der Prüfungen zu erbringen ist. Studien, die nach GLP-Vorschriften durchgeführt wurden, erhalten üblicherweise die Bewertung Klimisch-Score 1.3
Anforderungen an das Management im Labor
Neben den gängigen Vorgehensweisen des Qualitätsmanagements muss in Laboratorien zunächst ein System eingeführt oder entwickelt werden, mit dessen Hilfe eine ständige Qualitätskontrolle und ein reibungsloses Workflow-Management möglich ist. Wichtige Aspekte4 sind hierbei unter Anderem:
- Ablegen und Archivieren von Dokumenten im Rahmen der GxP-Vorgaben
- Reibungslose Kommunikation zwischen Third Parties und den verschiedenen internen Instanzen
- Überprüfung festgelegter Arbeitsschritte mit tatsächlicher Praxis
- Ergebnisse der externen Begutachtung und mögliche Verbesserungen
- Produktbewertungen der Kunden
- Vorbeugende Maßnahmen an Schwachstellen
- Schulungsstand des Personals
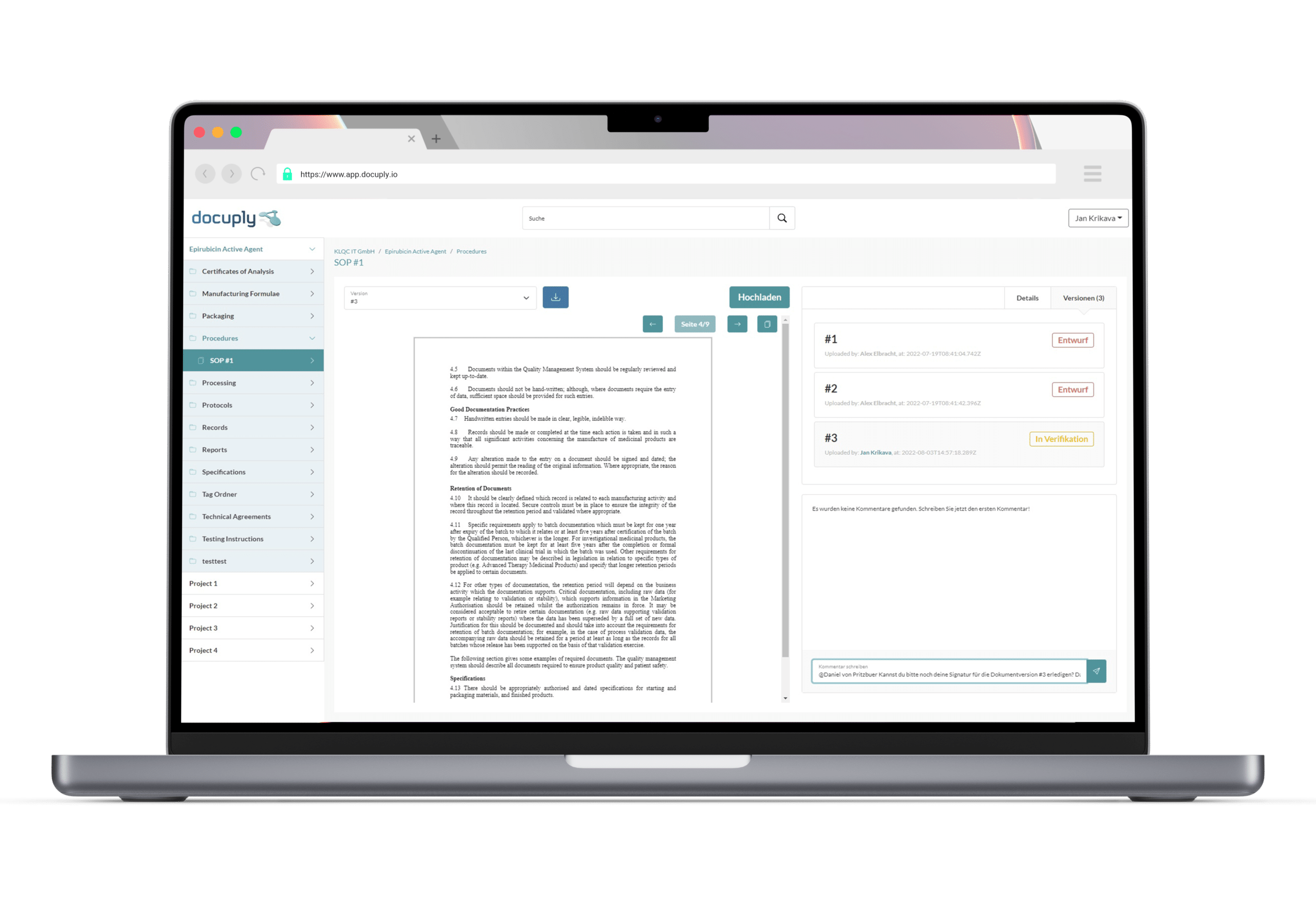
GLP-konforme Qualitätsmanagementsysteme
Im Hinblick auf die heutige Dezentralisierung des Marktes und der Zunahme an Kooperationen werden Unternehmen im Kontext der Qualitätssicherung vor große Herausforderungen gestellt. Hier schaffen spezielle Qualitätsmanagement- oder Dokumentenmanagementsysteme Abhilfe. Durch standardisierte Prozesse und Anbindungsmöglichkeiten an bestehende IT-Systeme können die Qualitätskontrollen erleichtert und Qualitätslücken schneller identifiziert werden. Die dadurch entstehende Zeit- und Ressourcenersparnis kann dazu beitragen die Entwicklung eines Produktes effizienter voranzutreiben.5