Regulatorische Anforderungen der Medikamentenzulassung
Definition
Die Zulassung eines neuen Medikamentes ist sowohl in der Pharma– als auch in der Biotechbranche strengen regulatorischen Anforderungen (eng.: Regulatory Affairs) unterzogen. Diese werden behördlich überwacht und in regelmäßigen Abständen überprüft. Gerade im Hinblick auf häufige Firmenkooperationen im Bereich Forschung und Entwicklung (F&E), stellt die Einhaltung der spezifischen Anforderungen, Unternehmen vor eine große Herausforderung. Betrachtet man den gesamten Lebenszyklus eines Medikamentes, werden diese Problematiken besonders im Zusammenspiel von Qualitätssicherung, Herstellung und Zulassung deutlich.1
Prüfung der Dokumente
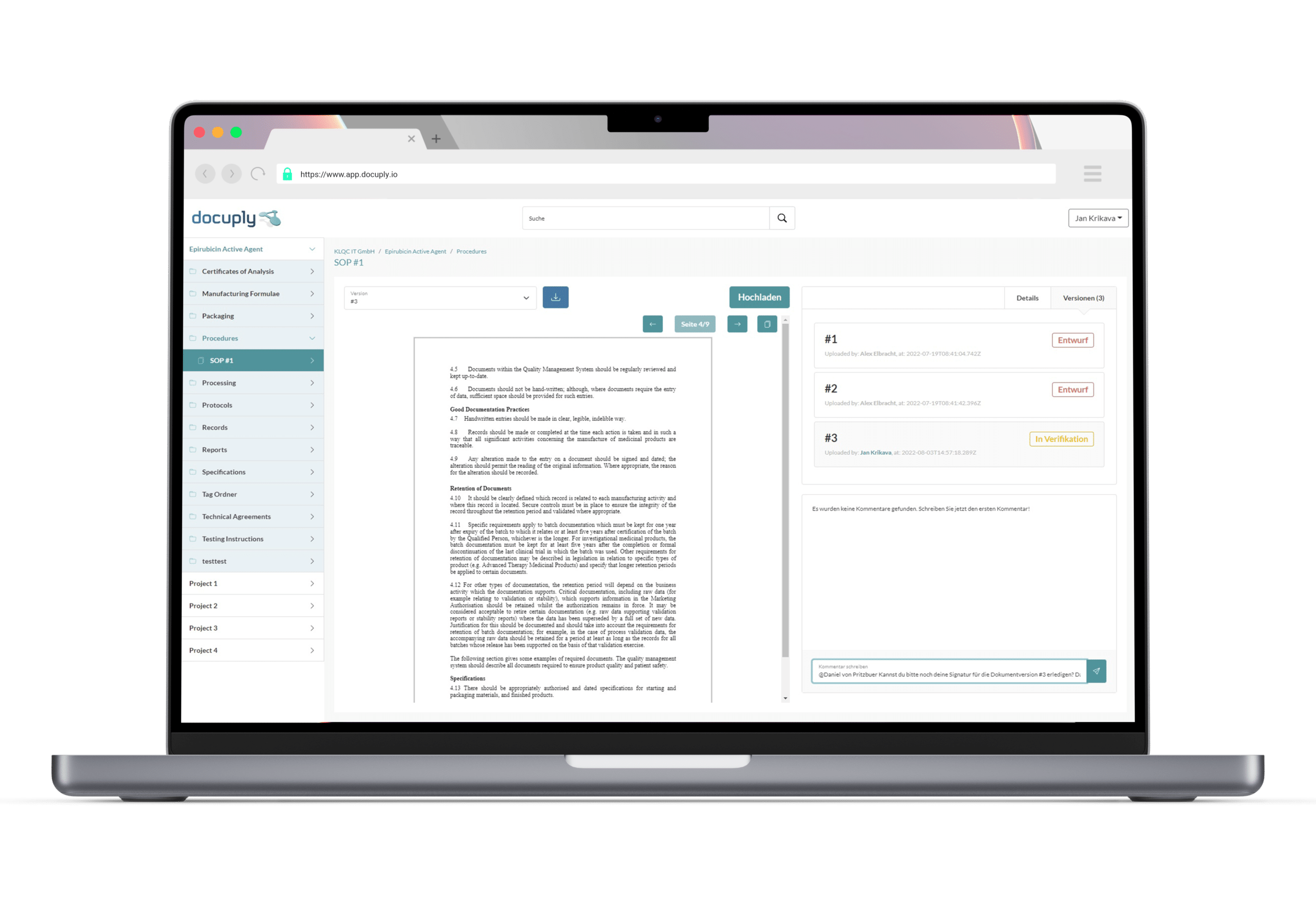
Der Hauptfokus des Zulassungsverfahrens ist die Sichtung der von Pharmaunternehmen vorgelegten Unterlagen, welche die Qualität, Wirksamkeit und Unbedenklichkeit belegen soll. Ein reibungsloses Dokumentenmanagement ist daher für Unternehmen und deren Qualitätssicherung essenziell. Neben den benötigten Dokumenten überwacht die Arzneimittelbehörde weiterhin, die verschiedenen Phasen der Arzneimittelstudien. Diese müssen den vorgeschriebenen Arzneimittelprüfrichtlinien, den empfohlenen internationalen Leitlinien sowie den Regeln der Guten Arbeitspraxis (GxP) entsprechen und sollten dem aktuellen wissenschaftlichen Standard entsprechen. Eine solche Überprüfung erfolgt meist durch behördlich angeordnete Inspektionen vor Ort.2
Pharmazeutische Qualität
Für die Zulassung ist es erforderlich, dass das Arzneimittel eine nach anerkannten pharmazeutischen Regeln angemessene Qualität aufweist. Diese regulatorischen Anforderungen sind unter anderem in Arzneibuch-Monografien festgelegt. Die vorzulegenden Unterlagen umfassen außer der Zusammensetzung des Arzneimittels ebenfalls die ausführliche Dokumentation des gesamten Herstellungsverfahrens, der Kontrolle der Ausgangsstoffe, verwendeter Verpackungsmaterialien, der Zwischen- und Fertigprodukte, sowie der durchgeführten Haltbarkeitsstudien. Darüber hinaus muss der Hersteller vor der Zulassung eines Medikaments eine Herstellungserlaubnis erlangen. Die Herstellung der Medikamente muss nach den Regeln der Good Manufacturing Practice (GMP) erfolgen. Zur Überprüfung werden vor Ort behördlich angeordnete Inspektionen durchgeführt. Bei Bedarf können ebenfalls Proben des Arzneimittels entnommen werden. Diese werden in Laboren des Arzneimittelamtes auf ihre pharmazeutische Qualität geprüft.3
Pharmazeutische Wirksamkeit
Um die Zulassung eines Medikamentes zu erlangen, wird außerdem eine angemessene Wirksamkeit in der angestrebten Indikation gefordert. Dies bezieht sich hierbei auf die Wahrscheinlichkeit, dass mit dem Arzneimittel therapeutische oder präventive Ergebnisse erzielt werden können. Die Medikamente werden hierbei unterschiedlichen Studien unterzogen, welche den Regeln der Good Clinical Practice (GCP) entsprechen müssen.4
Sicherheit der Arzneimittel
Auch die Unbedenklichkeit beziehungsweise die mögliche Schädlichkeit eines neuen Medikamentes wird vor der Zulassung beurteilt. Die Unbedenklichkeit eines Arzneimittels muss in klinischen und nichtklinischen Studien nachgewiesen werden. Die nichtklinische Überprüfung umfasst eine ausführliche Toxizitätsbestimmung, welche in geeigneten vitro- und Tierversuchen durchgeführt wird. In klinischen Studien werden alle Nebenwirkungen und schwerwiegenden unerwünschten Ergebnisse sorgfältig dokumentiert. Der formelle Rahmen für die Durchführung solcher klinischen und nichtklinischen Studien, sowie für die dementsprechenden Dokumentationen, werden durch die Regeln der Good Laboratory Practice (GLP)5