Was ist die Gute Herstellungspraxis?
Begriffsbestimmung
Unter dem Begriff Gute Herstellungspraxis (GMP) oder auch Good Manufacturing Practice werden verschiedene Richtlinien für Produktionsabläufe und -umgebungen zusammengefasst. Diese spezifischen regulatorischen Anforderungen dienen der Qualitätssicherung im Kontext der Produktion von Medikamenten, Wirkstoffen und Lebensmitteln. Insbesondere bei der Herstellung von pharmazeutischen und biotechnologischen Produkten spielt die Sicherung der Qualität eine maßgebliche Rolle. Abweichungen können hierbei direkte Auswirkungen auf die Gesundheit der Verbraucher haben. Um die Gewährleistung der Produktqualität und die Erfüllung der behördlichen Anforderungen zu sichern, werden häufig GMP-konforme Qualitätssicherungssysteme und zusätzliche Dokumentenmanagementsysteme eingesetzt.1
Wer erstellt die GMP-Richtlinien?
Die Richtlinien der Guten Herstellungspraxis werden wie auch bei der Guten Laborpraxis durch mehrere Instanzen entworfen. Hierzu zählen unter Anderem die Europäische Kommission, das Pharmaceutical Inspection Co-Operation Scheme (PIC/S), die US-amerikanische Food and Drug Administration (FDA) sowie auf globaler Ebene durch das International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH).2
Elemente eines GMP-konformen Qualitätsmanagementsystems
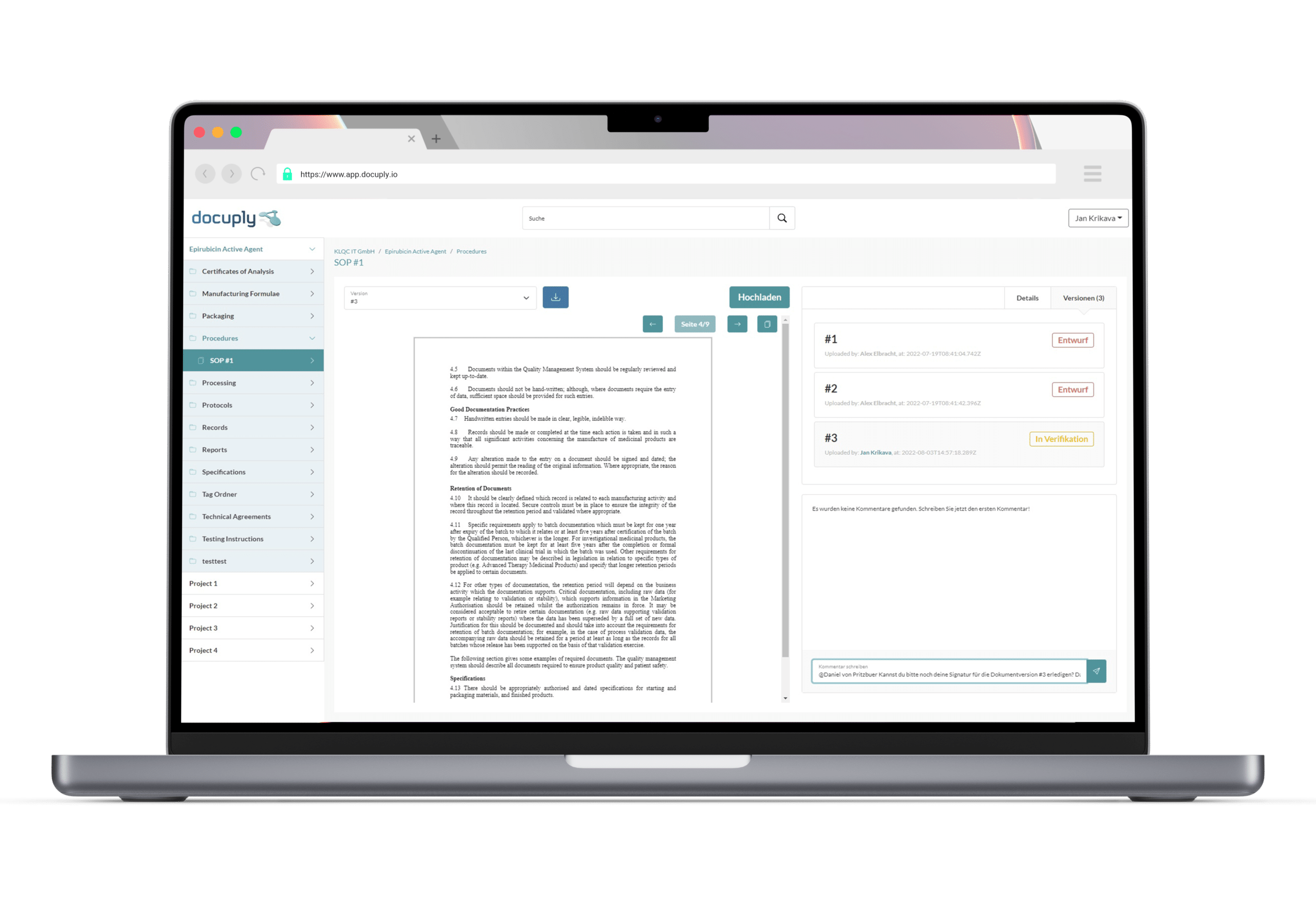
Ein auf GMP Richtlinien ausgelegtes Qualitätsmanagementsystem3 sollte folgende Elemente beinhalten:
- Dokumentenmanagement für Vorgabedokumente und Aufzeichnungen.
- Abweichungsmanagement: Prozesse, Verfahren und Methoden sind in Vorgabedokumenten beschrieben. Ungeplante Abweichungen der GMP-Richtlinien, müssen dokumentiert und bewertet werden.
- Änderungsmanagement: spezifische Änderungen von Verfahren oder Prozessen müssen vor der Umsetzung begründet, geplant und durch die Qualitätssicherung genehmigt werden.
- Qualifizierung von Ausrüstung: Die Eignung der Ausrüstung muss in einem geplanten und dokumentierten Prozess zeigen, dass sie für die speziellen Anforderungen und Absichten geeignet ist.
- Validierung von Prozessen und Methoden: Prozesse und Methoden müssen in einem geplanten und dokumentierten Prozess zeigen, dass sie den Anforderungen entsprechend verlässlich reproduzierbare Ergebnisse liefern.
- Schulung von Mitarbeitern: Mitarbeiter müssen vor beginn ihrer Tätigkeit in den entsprechenden Bereichen geschult werden und diese müssen dokumentiert werden.
- Risikomanagement
- Interne Audits
Spezielle Dokumentenmanagementsysteme für Pharma- und Biotechunternehmen
Um die spezifischen Anforderungen der GMP-Richtlinien im Kontext des Dokumentenmanagements zu erfüllen, wird häufig auf externe Software zurückgegriffen. Diese speziellen Dokumentenmanagementsysteme sind explizit auf die hohen Ansprüche in dieser Branche ausgelegt. Komplexe Arbeitsabläufe können mit Hilfe einer entsprechenden Software vereinfacht werden und zu einem reibungslosen Workflow beitragen. Die daraus resultierenden Zeit und Ressourcenersparnisse sorgen dabei für eine möglichst hohe Effizienz.4