Outsourcing bzw. Dezentralisierung
Begriffserklärung
Unter dem begriff Outsourcing kann eine unternehmerische Strategie verstanden werden, bei der einzelne Leistungen, Teilbereiche oder Geschäftsprozesse eines Unternehmens an Lieferanten ausgelagert und nicht mehr vom Unternehmen selbst erbracht oder übernommen werden. Dies führt häufig dazu, dass Kosten in den Bereichen der Produktion, Entwicklung und Service eingespart werden können. Ein weiterer Vorteil, der durch Outsourcing entsteht, ist die Stärkung der strategischen Marktposition. Hierbei können Unternehmen Kostenvorteile erzielen, indem sie sich mit entsprechenden Auslagerungen an Third Parties auf ihr Kerngeschäft konzentrieren können. Insbesondere durch den Einsatz professioneller Dienstleister kann eine Optimierung der Qualität erfolgen.1
Wieso outsourcen?
Das Outsourcing von Prozessen im Bereich Pharmazie und Biotechnologie, spielt für die Qualität des Produktes, sowie für die Sicherheit der Patienten, eine immer wichtigere Rolle. Vom Outsourcing betroffene Dienstleistungen reichen von der Arzneimittelherstellung über Forschung bis hin zu Logistik und Vertrieb. Externe Kooperationspartner sind oft in der Lage spezielle Aufgaben und Prozesse im Rahmen ihrer Kernkompetenzen effektiver, effizienter und innovativer umzusetzen. Das Auslagern von Prozessen birgt jedoch nicht nur Vorteile. Neben der Abwicklung der ausgelagerten Prozesse selbst, birgt auch die Wahl des Dienstleisters bzw. Lieferanten ein hohes Risiko. Schlussendlich liegt die Produktverantwortung immer beim pharmazeutischen bzw. biotechnologischen Unternehmer. Dieser muss also sicherstellen, dass die Produktion, Prüfung, Lagerung und Logistik eines pharmazeutischen oder medizinischen Produktes alle gesetzlichen und regulatorischen Anforderungen erfüllt.2
Die Rolle der Third Parties
Die Wahl der Kooperationspartner bzw. Third Parties ist in diesem Prozess von grundlegender Bedeutung, um auf Dauer eine höchstmögliche Qualität der Produkte, innerhalb der Supply Chain, zu gewährleisten. Vorab werden Lieferanten oftmals in gewisse Risikostufen eingeteilt, um die Auswahl zu späterem Zeitpunkt zu vereinfachen. Abhängig von der identifizierten Risikostufe, werden seitens der Unternehmen so genannte Vor-Ort-Audits durchgeführt, um bestehende Prozesse und Daten zu überprüfen. Hierbei wird ein detaillierter Einblick in die Systeme der Kooperationspartner ermöglicht. Diese Vor-Ort-Audits sind zudem in diesem Bereich gesetzliche Vorgabe und fallen unter die regulatorischen Anforderungen, welche im Kontext der GMP durchgeführt werden. Neben der Überprüfung und Ergänzung bestehender Daten können Audits ebenfalls die Kooperation zwischen Unternehmen und Partner fördern und mögliche Verbesserungspotenziale hervorbringen.3
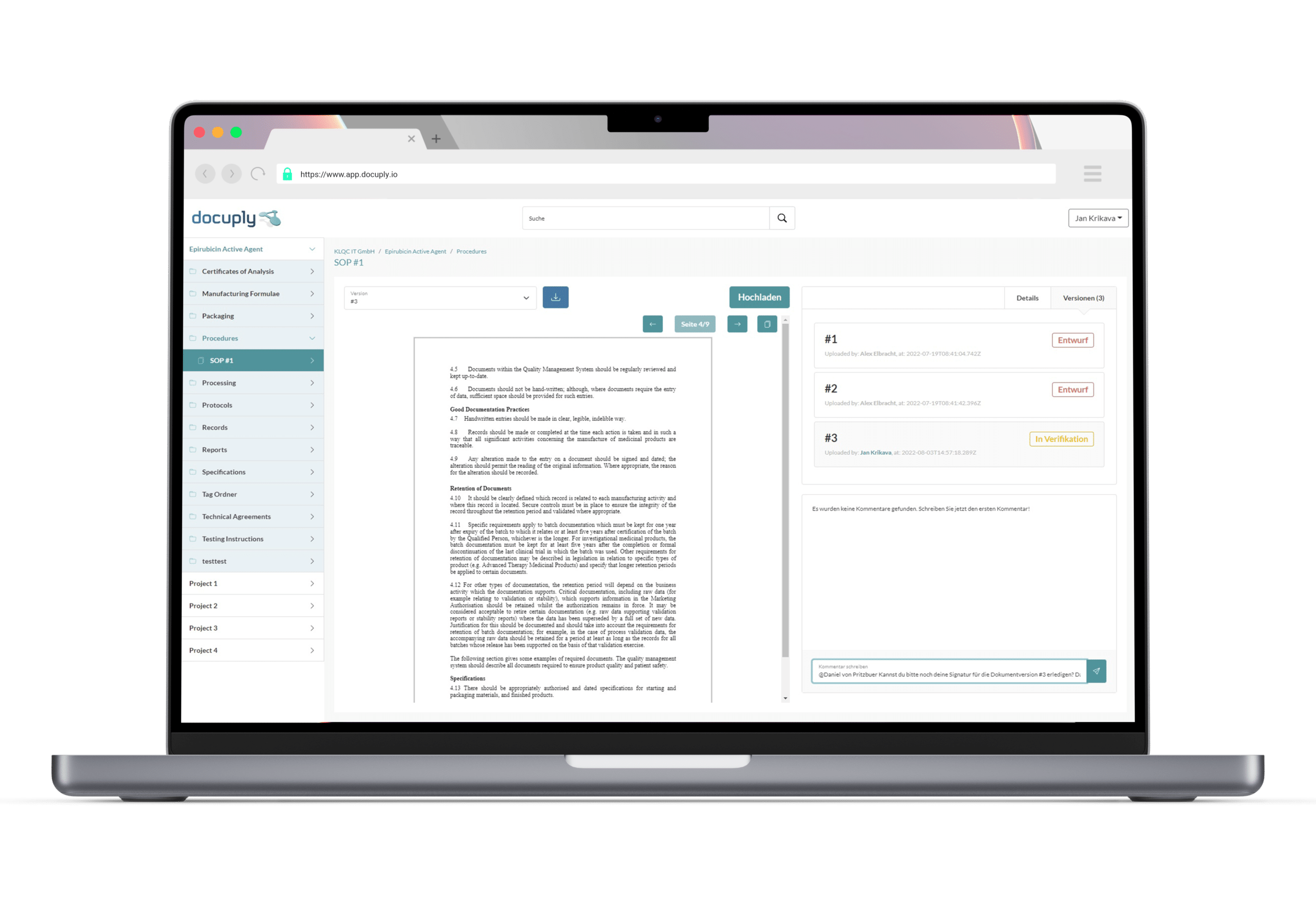
Dokumentenmanagementsysteme zur Qualitätssicherung
Die Sicherung der Qualität und ein entsprechendes Qualitätsmanagement sollte den gesamten Lebenszyklus einer Lieferantenbeziehung begleiten und kann als grundlegende Voraussetzung für eine erfolgreiche Zusammenarbeit mit Kooperationspartnern angesehen werden. Verschiedene Elemente der Qualitätssicherung helfen dabei den Prozess beherrschbar zu machen und die Konformität der GMP Anforderungen sicherzustellen. Neben der regulatorischen Anforderungen, ist ein wichtiger Punkt die genaue Beschreibung der einzelnen Prozesse und Verantwortlichkeiten. Hierbei sollte darauf geachtet werden die gesamte Struktur zu berücksichtigen. Viele pharmazeutische und biotechnologische unternehmen setzen dabei auf spezielle Dokumentenmanagementsysteme. Diese beinhalten häufig Tools und Funktionen, die speziell im Kontext der regulatorischen Anforderungen hilfreich sein können und ein reibungsloses Workflowmanagement ermöglichen. 4